
「電池」という単元は、電子、電流、イオン反応式などたくさんの用語が出てくるため何がどうなっているのかいまいちわかりにくい受験生も多いはずです。
しかし、電池は仕組みさえ理解すれば本当に簡単です。
覚えることも少ないので、ぜひ得点源にして下さい。
1,電池って何?
電池とは、酸化還元反応を利用して化学エネルギー―を電気エネルギーとして取り出す装置のことです。
酸化還元反応とは電子の移動が起こる反応ですが、どうやって電子の移動を起こすのでしょうか。
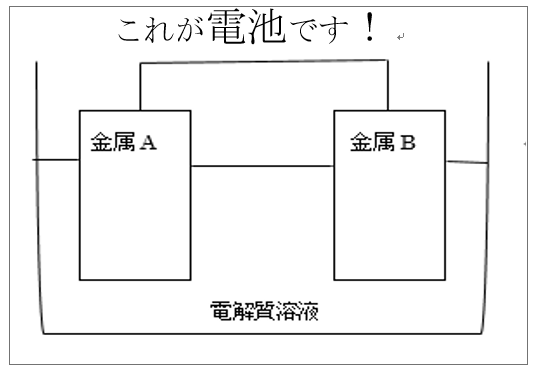
答えは、イオン化傾向の異なる2種類の金属(金属A、金属B)を電解質溶液に浸すのです。
金属を導線で繋ぐと電子の移動が起き、下図のように簡単に電池が出来ます。
>>1ヶ月で早稲田慶應・難関国公立の英語長文がスラスラ読めるようになる方法はこちら
2,電池の仕組み
たとえば、金属のイオン化傾向が金属Aは大きく、金属Bが小さい場合、電子の移動はどうなるのでしょうか。
金属は電子を放出し、陽イオンになります。
A→A++e-
つまり、この場合はイオン化傾向の大きい金属Aから電子が放出され、金属Bはそれを受け取るということです。
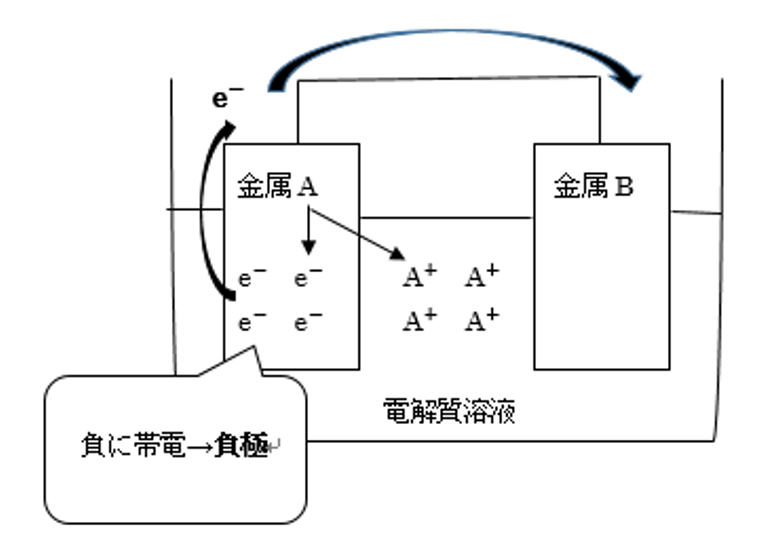
ここで、金属A、つまりイオン化傾向が大きく、電子をたくさん放出する方を負極(e-が多くなり負に帯電する電極と覚えましょう)と呼び、金属B、つまりイオン化傾向が小さく電子を受け取る方を正極と呼びます。
イオン化傾向が大きい金属
=(陽)イオンに化ける傾向が大きい(A→A++e-)
=電子を放出しやすい
=負極(電子が多く負に帯電する電極)となる
>>1ヵ月で英語の偏差値が40から70に伸びた「秘密のワザ」はこちら
3,電池の仕組み~ボルタ電池を例に~
ボルタ電池とは、電池式で表すと、
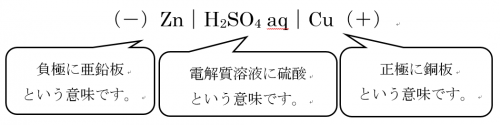
となります。
金属のイオン化傾向が大きい亜鉛板が負極に、イオン化傾向が小さい銅版が正極にあります。
次に、各電極での反応式を考えます。
ここで大切なことは、電解質水溶液に含まれるイオンや分子を図に描くこと。
今回は硫酸水溶液なので、H+とSO42-とH2Oを書き込みます。
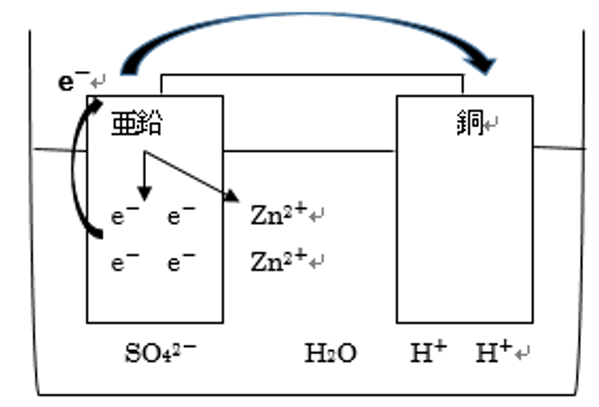
まず、負極の反応式は、亜鉛板が電子を放出し、亜鉛イオンになるということですので
Zn→Zn2++2e-
となります。そして、正極では受け取った電子が-の電荷を帯びているため、+の電荷を帯びた水素イオンが反応し、
2H++2e-→H2
となります。
このように、電池を理解するために、図を描き、必ず電解質水溶液のイオンを記入し、電子の流れを書き、「誰が電子を放出し、誰がその電子を受け取るのだろうか!」に着目し勉強を進めてみてください。
>>偏差値が1ヵ月で40から70に!私が実践した「たった1つのワザ」はこちら
4,計算問題の解き方
電池とは酸化還元反応によって電子を移動させ、電気エネルギーを取り出す装置です。
「電子」がなければ何も始まりませんので、計算問題でも注目すべきところは電子です。
たとえば、「ボルダ電池を用いた際、亜鉛1.3gが溶けると水素は何L発生するか」という問題のとき、必ずすべての数値をmolに換え、電子のmolを導いてみてください
Zn→Zn2++2e-より係数に着目すると… 亜鉛:電子=1:2
よって、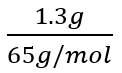 ×2=0.040mol←電子のmol
×2=0.040mol←電子のmol
この0.040molの電子が導線を流れ、
2H++2e-→H2 より係数に着目すると… 水素:電子=1:2
よって、0.040mol×1/2×22.4 L/mol=0.048L ←水素の体積
計算問題は、電池より電気分解の分野での出題が多いです。
複雑な計算問題でも、必ず一つ一つの反応式から係数をみて「電子:その他=●:△」を読み取り、molで計算し「電子のmol」に着目してみてください!
>>偏差値が1ヵ月で40から70に!私が実践した「たった1つのワザ」はこちら
5,電気分解との違い
電池 … 酸化還元反応を利用して化学エネルギー―を電気エネルギーとして取り出す装置
電気分解… 電解質溶液や融解駅に電極を入れ直流電流を通じ、酸化還元反応をおこす操作
端的に言うと、電池は「イオン化傾向の大きさが違う金属を使って、自然と電子を流す」に対し、電気分解は「電池によって無理やり電子を流す」ということです。
図を見て、どちらが電池でどちらが電気分解かも見分けましょう。
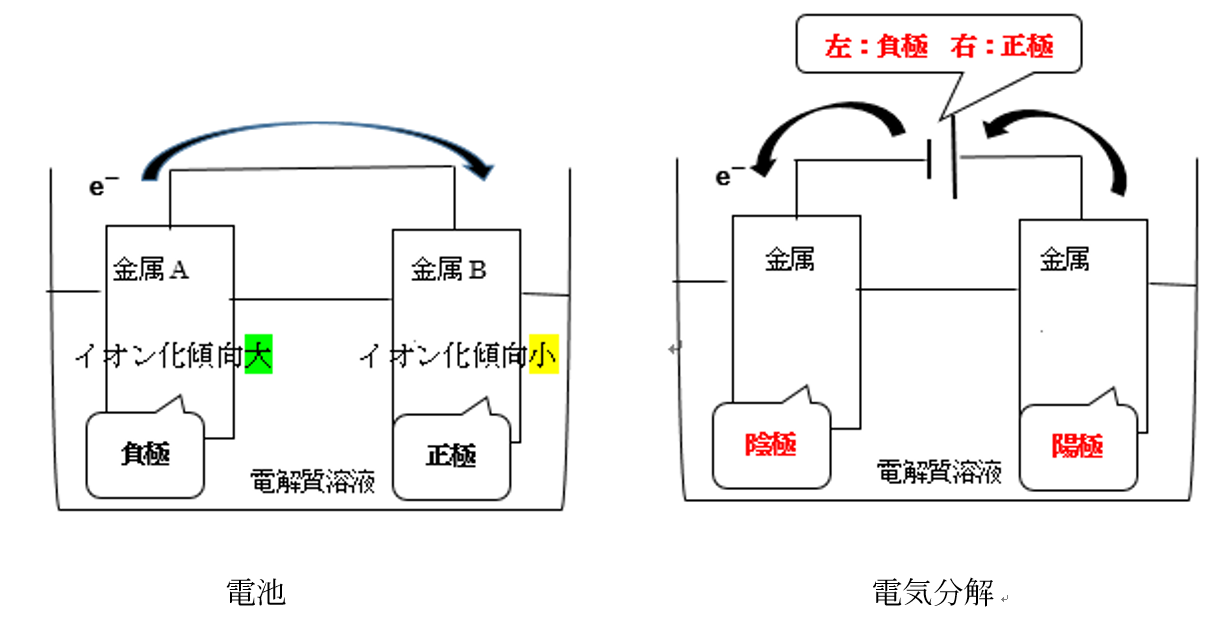
着目すべき点は、導線の部分。
電気分解は、「無理やり電子を流し」酸化還元反応を起こすために、電池が必要です。
また、電気分解の場合、金属板はイオン化傾向の大きさは気にせず、同じものでも大丈夫です。
この大きな違いを必ず覚えておきましょう。
>>偏差値が1ヵ月で40から70に!私が実践した「たった1つのワザ」はこちら
6,電池と電気分解まとめ
酸化還元反応を学習した後に習う電池ですが、その仕組みは「電子」に着目するだけでとてもシンプルな範囲です。
覚える電池の種類も少なく、また計算問題も「電子のmol」に着目する方法ができれば簡単に解くことができます。
また、応用問題にもきちっと対応できるよう、電気分解との違いは必ず明確にしておきましょう。
大切なのは「電池はイオン化傾向の異なる金属を使って自然に電子が流れ、電気分解は電池を使って無理やり電子を流す」それだけです。
ぜひ演習を重ね、得点源にしてください。
⇒1ヵ月で英語の偏差値が40から70に伸びた「秘密のワザ」はこちら
⇒【1カ月で】早慶・国公立の英語長文がスラスラ読める勉強法はこちら
⇒【速読】英語長文を読むスピードを速く、試験時間を5分余らせる方法はこちら
現役の時に偏差値40ほど、日東駒専に全落ちした私。
しかし浪人して1ヶ月で「英語長文」を徹底的に攻略して、英語の偏差値が70を越え、早稲田大学に合格できました!
私の英語長文の読み方をぜひ「マネ」してみてください!
・1ヶ月で一気に英語の偏差値を伸ばしてみたい
・英語長文をスラスラ読めるようになりたい
・無料で勉強法を教わりたい
こんな思いがある人は、下のラインアカウントを追加してください!
筆者は現役時代、偏差値40ほどで日東駒専を含む12回の受験、全てに不合格。
原因は「英語長文が全く読めなかったこと」で、英語の大部分を失点してしまったから。
浪人をして英語長文の読み方を研究すると、1ヶ月で偏差値は70を超え、最終的に早稲田大学に合格。
「1ヶ月で英語長文がスラスラ読める方法」を指導中。
⇒【秘密のワザ】1ヵ月で英語の偏差値が40から70に伸びた方法はこちら
⇒【1カ月で】早慶・国公立の英語長文がスラスラ読める勉強法はこちら
⇒【速読】英語長文を読むスピードを速く、試験時間を5分余らせる方法はこちら











