


ヘンリーの法則とは?
ヘンリーの法則は温度が一定のとき、気体の溶解度はその気体の圧力に比例するという法則。
1803年にウィリアム・ヘンリーが発見しました。
言い換えれば、圧力が大きくなればなるほど気体に溶ける量が増えるということです。
ヘンリーの法則は酸素(O₂)、水素(H₂)など、水への溶解度が小さい気体で成り立ちます。
ヘンリーの法則が成り立つ物質は水に溶けたとしても、分子の形が変化しないものが当てはまります。
一方、ヘンリーの法則が成り立たない物質として塩化水素(HCl)やアンモニア(NH₃)があります。
塩化水素やアンモニアは水に溶けるとH⁺やCl⁻、NH₄⁺そしてOH⁻のイオンが発生します。
イオンが発生すると、ヘンリーの法則に当てはめることができません。
HClやNH₃はヘンリーの法則が成り立たないので注意しましょう。
>>1ヶ月で早稲田慶應・難関国公立の英語長文がスラスラ読めるようになる方法はこちら
ヘンリーの法則の勉強法と試験で問われるポイント
ヘンリーの法則は、理論化学でつまずきやすい分野となっています。
その原因としてはヘンリーの法則の定義が2つあるからです。
一定温度で一定量の溶媒に対し
①溶媒に溶ける気体の物質量は、圧力に比例する(物質量と圧力の関係)
②溶媒に溶ける気体の体積は、その圧力にかかわらず一定になる(体積と圧力の関係)
①は圧力が大きければ大きいほど、溶解度は増加するということです。
問題となるのは②です。
「①は増加すると書いてあるのに、一定ってどういうこと?」と思いますよね。
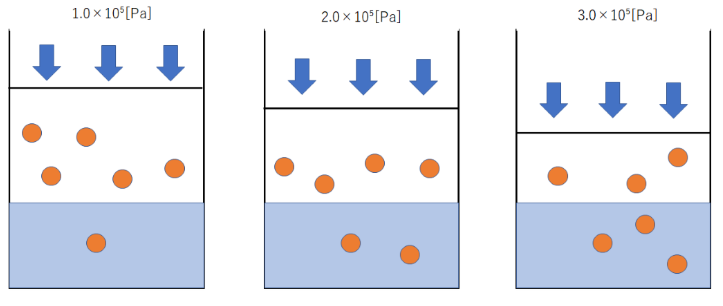
例えば圧力が1.0×10⁻⁵のときに気体1L、物質量0.5molが溶けるとします。
温度が同じとき圧力が2.0×10⁻⁵になったとき、ヘンリーの法則に当てはまると、溶ける気体は1Lで溶ける物質量は1molになるということです。
これを気体の状態方程式PV=nRTを用いて考えてみましょう。
まず圧力がP[Pa]のとき、物質量n[mol]溶けたとき。
このとき体積はV=nRT/P…⑴となります。
次に圧力が2P[Pa]になった時を考えます。
このとき溶ける物質量は2n[mol]となり、体積はV=2nRT/2P=nRT/P…⑵になります。
⑴、⑵の式から圧力が増えても溶ける気体の体積は一定になることがわかりますね。
ヘンリーの法則を利用する問題は、気体の溶解度を求める問題が大半。
溶解度を求める問題には、1つの気体だけのものと混合気体(2つの気体)のものがあります。
1つの気体の問題は、問題で示されている圧力をそのままヘンリーの法則に当てはめれば解くことができます。
しかし混合気体だと、分圧を考えなくてはなりません。
混合気体の問題を解くときは、初めに分圧を求め、分圧を出すことができたらヘンリーの法則に当てはめて問題を解いていきましょう。
中には圧力でなく、体積が示されている問題があります。
この時は状態方程式PV=nRTを用いて質量や分子量を求めましょう。
>>1ヵ月で英語の偏差値が40から70に伸びた「秘密のワザ」はこちら
ヘンリーの法則の解説と勉強法まとめ
ヘンリーの法則は難しく見える部分もありますが、図や式で考えると分かりやすくなります。
入試でも出題されやすい部分なので、きちんと理解して勉強を進めていきましょう。
⇒1ヵ月で英語の偏差値が40から70に伸びた「秘密のワザ」はこちら
⇒【1カ月で】早慶・国公立の英語長文がスラスラ読める勉強法はこちら
⇒【速読】英語長文を読むスピードを速く、試験時間を5分余らせる方法はこちら
現役の時に偏差値40ほど、日東駒専に全落ちした私。
しかし浪人して1ヶ月で「英語長文」を徹底的に攻略して、英語の偏差値が70を越え、早稲田大学に合格できました!
私の英語長文の読み方をぜひ「マネ」してみてください!
・1ヶ月で一気に英語の偏差値を伸ばしてみたい
・英語長文をスラスラ読めるようになりたい
・無料で勉強法を教わりたい
こんな思いがある人は、下のラインアカウントを追加してください!
筆者は現役時代、偏差値40ほどで日東駒専を含む12回の受験、全てに不合格。
原因は「英語長文が全く読めなかったこと」で、英語の大部分を失点してしまったから。
浪人をして英語長文の読み方を研究すると、1ヶ月で偏差値は70を超え、最終的に早稲田大学に合格。
「1ヶ月で英語長文がスラスラ読める方法」を指導中。
⇒【秘密のワザ】1ヵ月で英語の偏差値が40から70に伸びた方法はこちら
⇒【1カ月で】早慶・国公立の英語長文がスラスラ読める勉強法はこちら
⇒【速読】英語長文を読むスピードを速く、試験時間を5分余らせる方法はこちら











