


記事と筆者の信頼性
・難関大学に化学受験で合格した人が記事を執筆
・早稲田大学卒の予備校講師が、さらに分かりやすく編集
・編集者は予備校講師として、2,000人以上の受験生を指導
目次
化学反応式とは?具体例で分かりやすく
化学反応は、ゆっくりとした反応からとても速い反応まで様々です。
ゆっくりの反応と、速い反応に分けてそれぞれ、詳しく解説していきます!
ゆっくりとした化学反応


鉄が錆びるときには、鉄と水と空気中の酸素とが反応することで水酸化鉄(Ⅲ)が生じる、酸化という化学反応が起きています。
4Fe + 3O2 + 6H2O → Fe(OH)3
この反応では熱も発していますが、とてもゆっくりとした反応であり、その熱を感じるのはとても難しいでしょう。
鉄製の鍋が水で濡れたからと言って、一瞬で目に見えて起きるような速い反応ではありません。
錆びていく鍋を触っていて「熱い!」と感じることもありません。
速い化学反応
同じ反応でありながらも。とても速く反応が起きることもあります。
この時は熱をしっかり感じることができます。


使い捨てカイロは袋の中では少しも熱くありませんが、袋から出すとすぐに熱くなってきますよね。
そして何時間もその反応を止めることができずに、どんどん熱を発していきます。
あれもカイロの中の鉄粉と水、空気中の酸素とが反応することで水酸化鉄(Ⅲ)が生じており、その際に生じた熱を利用して私たちは暖かいと感じるわけです。
このように同じ化学反応でも反応の速さに違いが生じています。
日常生活の中や、または実験の中で実感する「この反応は速いな!」「この反応は遅いな!」という速さをより明確にするには、やはり数値(または式)で表すことが必要でしょう。
「どれくらいなら速い」、「どれくらいなら遅い」というのは、人によって感じ方が違いますからね。
誰でもわかる、共通の数値や数式を反応の速さの基準を作るわけです。
化学反応の速さの基準を示すのが反応速度式
共通の数値や数式として、「反応速度式」が登場します。
受験化学の理論化学の分野でも、頻出の項目です。
計算問題でよく出るグラフの読み方、そして反応速度式という式の意味を理解していきましょう。
反応速度式はどういう定義なのか、どうすれば反応速度が変わるのかをまとめていきます。
考え方を深く理解することで、定期テストや入試問題が解けるようになっていきます。
>>1ヶ月で早稲田慶應・難関国公立の英語長文がスラスラ読めるようになる方法はこちら
1.反応速度式の表し方
たとえば、このような化学反応があったとします。
反応物(A+B)→生成物(C+D)
化学反応では反応が進むにつれて、反応物が減少していき、それと同時に生成物が増加していきます。
Aのモル濃度の変化に着目すると、以下のようなグラフになります。
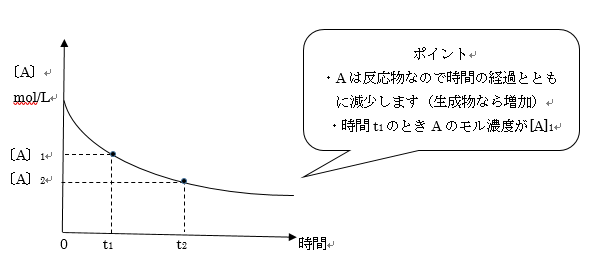
反応速度は単位時間当たりの濃度(mol/Lなど)の変化量で表します!
質量や個数、物質量(mol)の変化量ではありませんよ!
これは化学反応式の定義で重要なことであるだけでなく、後で説明する反応速度を変えるもので深く関わってくる考え方なので、しっかりおさえておきましょう。
ここで反応速度vを次のように定義します。
反応速度 v=反応物の濃度の減少量/反応時間
もしくは v =生成物の濃度の増加量/反応時間
今回の場合はAのモル濃度の変化率に着目すれば良いので、[v=-[A]2ー[A]1/t2ーt1]となります。
ポイント
反応速度は常に正の値で表すという約束があります。
そこで今回はAのモル濃度が減っていく反応なので、マイナスがついています。
>>1ヵ月で英語の偏差値が40から70に伸びた「秘密のワザ」はこちら
2.化学反応の仕組み~反応速度を変化させるもの~
反応速度の変化させるものを考えてみましょう。
冒頭で紹介したような「酸化の反応速度の違いはどのようにして生じるのか?」ということです。
鉄製の鍋が錆びるのもカイロが暖かく感じるのもどちらも同じ化学反応なわけで、鉄と空気中の酸素とが反応することで水酸化鉄(Ⅲ)が生じています。
これら二つの間で何が違うのかを意識しながら、反応速度を変化させるものを順に見ていきましょう。
反応速度式の解説①活性化エネルギー
化学反応は下図のようにして起こります。
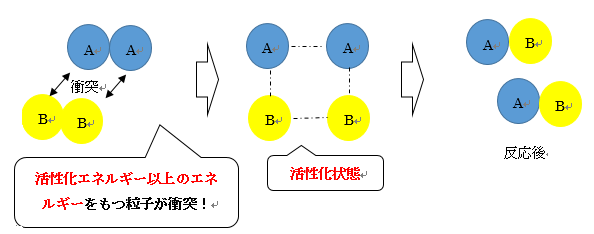
化学反応を起こすには、反応物同士が出会う必要があるわけです。
それぞれの粒子が衝突しているのですが、ただ粒子同士が衝突すれば反応が始まるわけではありません!
活性化エネルギーと呼ばれるあるエネルギー以上のエネルギーをもつ粒子同士が衝突し、「活性化状態」という過程を経たのちに、反応が起こるのです。
下記のグラフはこれを表したものです。
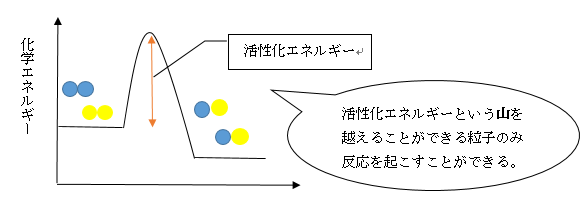
縦軸が粒子の持つ化学エネルギー量を表し、横軸が時間軸を表しています。
グラフにおける反応物と生成物のエネルギーは、「粒子全体のエネルギーの平均がこれくらい」というものです。
そのため、これ以上のエネルギーを持った「元気な」粒子も、これ以下のエネルギーを持った「元気じゃない」粒子もいるわけですね。
活性化エネルギーという山を超えられるほど元気な粒子が、活性状態を経て反応物へと移っていくわけです。
活性化エネルギーが化学反応の速度の基準となります。
メモ
ちなみに、活性化エネルギーは触媒に影響を受けます。
触媒とは「反応の前後では変化せず、少量でも反応速度に影響を与える物質」のこと。
正触媒とは「活性化エネルギーを小さくし、反応速度を大きくするような触媒」のことを示します。
>>偏差値が1ヵ月で40から70に!私が実践した「たった1つのワザ」はこちら
反応速度式の解説②温度

①で述べた「粒子が活性化エネルギー以上のエネルギーを持つ」ためにはどうすればいいのでしょうか?
答えは簡単です。
粒子の持つ運動エネルギーを高める、すなわち温度を上げるのです。
温度が上がれば、その熱を受け取って元気になれる粒子が増えるわけですね。
高温になるほど粒子が活性化状態になる確率が高くなり、反応速度は大きくなります!
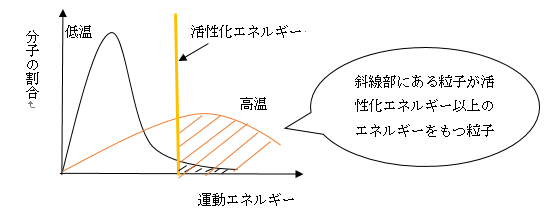
このグラフは横軸が粒子の運動エネルギーを表し、縦軸はそれぞれのエネルギーの粒子がどれくらいの割合を占めているかを表しています。
黒線が表す低温時では、活性化エネルギーよりも小さいエネルギーの粒子の割合が大きいですね。
それに対してオレンジの線が表す高温時では、粒子の分布の山が活性エネルギーより右側にあります。
活性化エネルギー以上のエネルギーを持つ「元気な粒子」が多くなっているわけです。
反応速度式の解説③衝突回数
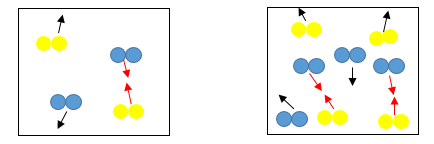
温度を上げて元気な粒子を増やす以外にも、衝突回数を増やすことで反応速度は大きくなります。
衝突回数を増やすためにはどうすればいいでしょうか。
反応物の濃度大きくするわけです。
街中の混雑したところでは余計に他の人とぶつかりそうになります。
反応物の濃度を大きくすると、衝突する確率が高くなるため、反応速度が大きくなるわけです。
反応速度の3つの要素まとめ
①活性化エネルギー
②温度
③衝突回数
3.反応速度式
ここまで見てきた反応速度は、Aという1種類の反応物に着目したものでした。
粒子Aの反応速度 v=-([A]2ー[A]1)/(t2ーt1)
それでは反応全体、つまりxA+yB→zCという反応式全体の反応速度式vを考えます。
それは次のようになります。
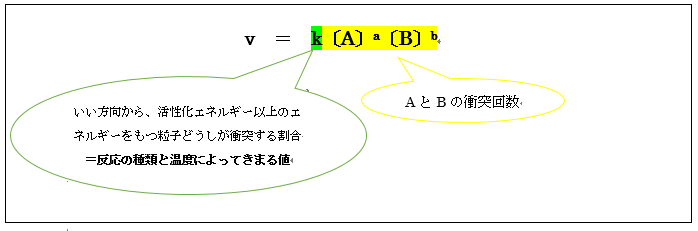
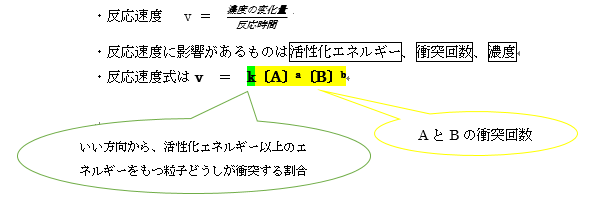
v=k〔A〕a〔B〕b

>>1ヵ月で英語の偏差値が40から70に伸びた「秘密のワザ」はこちら
〔A〕a〔B〕bについて
Aのモル濃度とBのモル濃度がなぜ掛け算されているのか解説していきます。
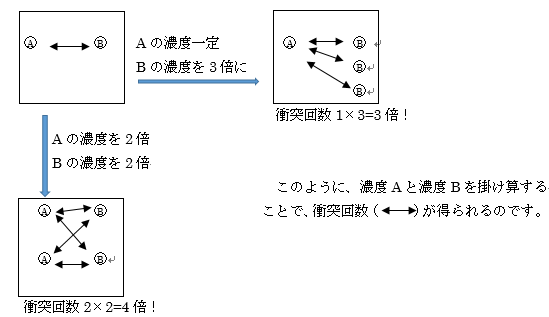
このように考えると、粒子Aが増えれば衝突回数が増え、粒子Bが増えれば衝突回数が増えるというのも当然に感じられるでしょう。
またv = k〔A〕a〔B〕b のaやbのことを反応の次数といいます。
それぞれの濃度をa乗、b乗という掛け算をしているわけです。
一般に、ただ1つの段階だけで完結する反応(素反応)の場合に限っては、反応式の係数が反応速度式の次数に一致します。
例)2HI → H2+ I2 ⇒ v = k〔HI〕2
多段階反応
実際、多くの化学反応は複数の素反応が組み合わさり進行する反応(いくつかの中間体を経て進む反応)です。
このような反応を多段階反応といいます。
例)2H2O2 → 2H2O + O2
v = k 〔H2O2〕反応式での過酸化水素の係数は2ですが、反応速度式の次数は1ですね。
これはイオン反応式という発展的な反応式で表すと、2つの反応
H2O2 + 2H+ + 2e- → 2H2O
H2O2 → 2H+ + O2 + 2e-
の組み合わせからできているわけです。
どちらの反応式に着目しても、過酸化水素の係数は1ですし、反応速度式の次数が1なのが見えてきます。
この2つを合わせると最初の式になるわけですね。
反応の次数は反応式の係数と同じでないことがあること、そしてその場合は実験(細かい反応)によって次数が求められることを知っておきましょう。
>>1ヵ月で英語の偏差値が40から70に伸びた「秘密のワザ」はこちら
k(反応速度定数)について
粒子同士がただ衝突するだけでは、反応は起こりません。
必ず活性化エネルギー以上のエネルギーをもつ粒子同士が衝突する必要があります。
また反応を起こすための、都合の良い方向から衝突する必要もあります。
例えば粒子の表面をカスるだけの衝突をしたり、追いかけるように衝突したりするよりも、正面衝突する方が大きなエネルギーのまま衝突できるのです。
よってkは、全衝突回数に対して以上の2点を踏まえた反応の起こる可能性(割合)であることをおさえましょう。
反応速度式の解説まとめ
>>1ヶ月で英語の偏差値が30伸びた!最強の英語長文の読解法はこちら
4.反応速度式の計算問題の解き方のコツ
反応速度の問題は表の見方、そして1つ1つの問いに対しての解答方法を覚えておくことが大切。
反応速度式<例題1 簡単な問題>
A+B→Cで表される反応がある。
ある温度で、反応物(A、B)の濃度を変えそれぞれの瞬間の反応速度を調べたところ、以下の表の結果が得られた。
この反応の反応速度式を求めなさい。

<解説>
一方の濃度を一定にし、他方の濃度と反応速度の関係性を確かめよう!
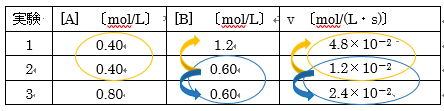
Aの濃度が一定(実験1と実験2)のとき、オレンジ色の矢印に着目すると、Bの濃度が2倍のとき、反応速度は4倍となっている。
次数は2となり、v = k[A]a[B]2
Bの濃度が一定(実験2と実験3)のとき青色の矢印に着目すると、Aの濃度が2倍のとき、反応速度は2倍となっている。
よって次数は1となり、v = k[A][B]2
答え v = k[A][B]2
>>1ヵ月で英語の偏差値が40から70に伸びた「秘密のワザ」はこちら
反応速度式<例題2 応用問題>
体積一定のもと、温度を約45℃に保ち、五酸化二窒素の分解反応2N2O5→2N2O4+O2を行った。
下記の表はその実験結果である。
この後問題は様々問われるが、まずこの2点を答えられるようにしよう
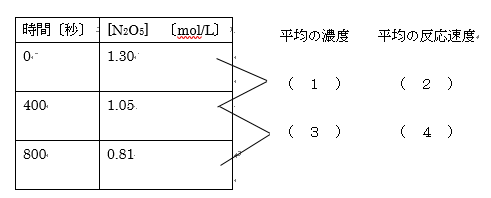
2つのポイント
①平均の反応速度
②平均の濃度
①平均の反応速度
( 2 )( 4 )
v=反応物の濃度の減少量/反応時間 または
v=生成物の濃度の増加量/反応時間
0秒~400秒:-1.05-1.30/400-0 = 6.25×10-4 mol/(L・s)
400秒~800秒:- 0.81-1.05/800-400 = 6.00×10-4 mol/(L・s)
②平均の濃度
( 1 )( 3 )
その時間の最初と最後の濃度の平均で求めよう。
0秒~400秒:1.30+1.05/2=1.175mol/L
400秒~800秒:1.05+0.81/2=0.930 mol/L
回答パターン①
各区間の平均速度とそれに対する平均の濃度をグラフに表す
縦軸を平均速度、横軸を平均の濃度にし、グラフに表す。
今回は(あと2つほどデータが欲しいが)比例関係のグラフが書けるため、vはN2O5の濃度に比例する。
すなわち、v = k[N2O5]が導かれる。
回答パターン②
反応速度式が与えられ反応速度定数kの値を平均値から求める
問題文において、v=k[N2O5]が与えられており、平均の濃度と平均の反応速度をこの式に代入し、kを求める。
その後kの平均値を求め、答えを導く。
5.反応速度式の求め方と計算方法の解説まとめ
⇒1ヵ月で英語の偏差値が40から70に伸びた「秘密のワザ」はこちら
⇒【1カ月で】早慶・国公立の英語長文がスラスラ読める勉強法はこちら
⇒【速読】英語長文を読むスピードを速く、試験時間を5分余らせる方法はこちら
現役の時に偏差値40ほど、日東駒専に全落ちした私。
しかし浪人して1ヶ月で「英語長文」を徹底的に攻略して、英語の偏差値が70を越え、早稲田大学に合格できました!
私の英語長文の読み方をぜひ「マネ」してみてください!
・1ヶ月で一気に英語の偏差値を伸ばしてみたい
・英語長文をスラスラ読めるようになりたい
・無料で勉強法を教わりたい
こんな思いがある人は、下のラインアカウントを追加してください!
筆者は現役時代、偏差値40ほどで日東駒専を含む12回の受験、全てに不合格。
原因は「英語長文が全く読めなかったこと」で、英語の大部分を失点してしまったから。
浪人をして英語長文の読み方を研究すると、1ヶ月で偏差値は70を超え、最終的に早稲田大学に合格。
「1ヶ月で英語長文がスラスラ読める方法」を指導中。
⇒【秘密のワザ】1ヵ月で英語の偏差値が40から70に伸びた方法はこちら
⇒【1カ月で】早慶・国公立の英語長文がスラスラ読める勉強法はこちら
⇒【速読】英語長文を読むスピードを速く、試験時間を5分余らせる方法はこちら











